de cáncer de mama
Tipos de células y tipos de tumores
- Escrit per: Equip de redacció
- Categoria: General
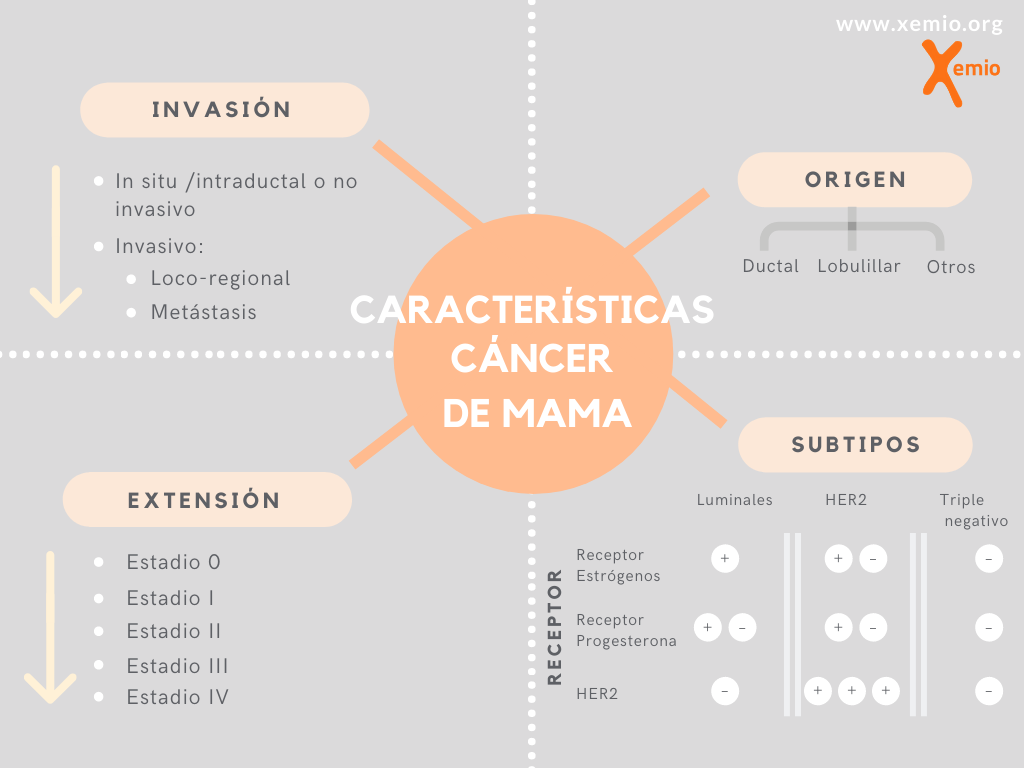
Podemos diferenciar el cáncer de mama en base a diferentes características:
- Origen celular
- Capacidad infiltrante
- Subtipo molecular
- Estadio o grado de extensión
a. Origen celular
La mayoría de los cánceres que afectan a la mama son carcinomas. Según la célula de la que provengan podemos hablar de:
- Carcinoma ductal: de la superficie del ducto mamario. El más frecuente.
- Carcinoma lobulillar: del lobulillo de la glándula mamaria.
- Otros: mucinoso, tubular, medular, papilar, metaplásico, apocrino, phyllodes, Paget de la mama…
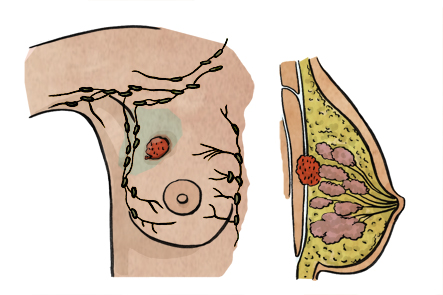
b. Capacidad infiltrante:
El carcinoma se denomina in situ o no invasivo cuando las células crecen pero no han adquirido capacidad infiltrante, manteniéndose dentro del conducto e invasivo o infiltrante cuando las células consiguen crecer más allá de las paredes del conducto. Estas células con capacidad infiltrante pueden diseminarse a otras zonas del cuerpo a través de la sangre y/o de los vasos linfáticos o sistema ganglionar. Cuando se produce una afectación exclusiva de los ganglios cercanos a la mama (habitualmente axilares), hablamos de afectación tumoral loco-regional. Cuando las células tumorales, originadas inicialmente en la mama, consiguen llegar a otras zonas del cuerpo más lejanas, hablamos de metástasis.
c. Subtipo molecular
Las células del cuerpo humano tienen en su superficie proteínas o receptores que actúan como “interruptores” de encendido y apagado. Estos receptores, reciben mensajes de sustancias que circulan por la sangre y les indican qué hacer. Los receptores sirven para regular el metabolismo y la actividad normal de las células. Las células cancerígenas también tienen receptores, generalmente más que las células normales, que cuando se estimulan o “encienden” por sustancias presentes en la sangre favorecen su crecimiento, multiplicación, invasión, etc.

Conocemos diferentes receptores en las células tumorales, siendo los principales:
- Receptor de estrógeno y progesterona: estos receptores están presentes en las células mamarias normales y en otros órganos del cuerpo como los ovarios y los huesos. Su función está regulada por las hormonas del mismo nombre. En la mujer, intervienen en el ciclo menstrual, el desarrollo sexual, el embarazo, la menopausia, etc. Los hombres también tienen estas hormonas y sus receptores, aunque en niveles más bajos, y están implicados principalmente en la salud de los huesos y el colesterol. En el cáncer de mama, las células tumorales suelen tener más receptores, lo que las hace más sensibles a las hormonas que favorecen su crecimiento.
- Receptor HER2 o factor de crecimiento epidérmico humano: de manera natural, este receptor está relacionado con el crecimiento celular. Cuando se encuentra sobreexpresado o amplificado en la superficie celular tumoral (más receptored de lo habitual), su activación contribuye al crecimiento anómalo de las células malignas.
Dependiendo de la presencia o ausencia de estos receptores, podemos clasificar el cáncer de mama en cuatro tipos distintos. Esta clasificación es muy importante porque permite seleccionar el tratamiento que un paciente puede recibir para tratar su enfermedad de manera más eficaz y personalizada:
- Tumores luminales, hormonodependientes, hormonosensibles. Son los que expresan receptores de estrógenos y/o progesterona. Su crecimiento está regulado por estas hormonas. Son el subtipo más frecuente, cerca del 70% de los casos. Estos tumores se clasifican a su vez en dos subtipos:
Luminales A: alta expresión de receptor de estrógenos y de progesterona, así como bajo índice de proliferación o valor Ki67 (porcentaje de células que se están multiplicando: a mayor porcentaje, mayor velocidad de crecimiento tumoral). En general, son tumores muy sensibles al tratamiento hormonal (fármacos que disminuyen la cantidad de hormonas del cuerpo o evitan su acción) y menos a la quimioterapia.
Luminales B: la expresión de receptores de hormonas es más baja, así como mayor valor de Ki67. Son también sensibles al tratamiento hormonal, aunque su hormonosensibilidad es más variable que en los luminales A, pudiendo también ser más sensibles a la quimioterapia.
- Tumores HER2 positivo: aquellos que presentan el receptor de HER2 amplificado o sobreexpresado en la membrana celular. Como parte de su tratamiento, se emplearán fármacos que bloquean directamente esta proteína, los llamados tratamientos anti-HER2, impidiendo su activación y evitando el crecimiento tumoral. Pueden presentar además positividad o negatividad de los receptores hormonales. Suponen un 15-20% de los casos.
- Tumores triple negativo: carecen de receptores hormonales y de sobreexpresión de HER2. Al no estar expresados, son tumores que no responden al tratamiento hormonal ni anti-HER2, por lo que su tratamiento actual se basa en quimioterapia, añadiendo inmunoterapia en algunas ocasiones. Representa un 10 - 15% de los tumores de mama.
d. Estadio tumoral
Cuando se diagnostica un cáncer, es importante saber cuánta enfermedad existe, ya que será fundamental para elegir el mejor tratamiento. Tendremos que saber el tamaño del tumor primario, si existe afectación de los ganglios locales y si existen células a distancia o metástasis. Para ello, se emplea el sistema TNM, por sus siglas en inglés: tamaño del tumor (T), nódulos o ganglios linfáticos (N) y metástasis (M). Con estos tres datos clasificaremos a los tumores en diferentes estadios, siendo 0 para los tumores no infiltrantes, y entre I y IV para los infiltrantes, en base a su extensión.
El estadio IV es el más avanzado, se presenta cuando las células tumorales localizadas inicialmente en la mama han adquirido la capacidad de “viajar” a través del torrente sanguíneo o el sistema linfático y asentarse en otras áreas del cuerpo, proceso conocido como metástasis. A diferencia de los estadios tempranos del cáncer de mama (I al III), donde el tratamiento puede enfocarse en la curación, el cáncer metastásico se considera crónico. Esto significa que, aunque no se puede erradicar completamente, puede ser manejado con terapias cada día más eficaces para retrasar su crecimiento y aliviar los síntomas.
Clasificación por estadios:
- Estadio 0: Carcinoma in situ o no invasivo.
- Estadio I: el tumor es menor o igual a 2 cm, sin afectación ganglionar.
- Estadio II: El tumor es menor o igual a 2 cm y tiene ganglios en la axila positivos. El tumor mide entre 2 y 5 cm con o sin afectación axilar. Por último, el tumor mide más de 5 cm pero no tiene afectados los ganglios.
- Estadio III: el tumor mide más de 5 cm y tiene afectación de los ganglios, o el tumor presenta afectación cutánea y/o de la pared torácica o presenta importante afectación ganglionar (en forma de mazacote o masa no móvil o afectación de ganglios infra o supraclaviculares).
- Estadio IV: existe afectación de otros órganos a distancia, es decir presenta metástasis.
Tumor
Tis: carcinoma in situ
T1: Tumor ≤20 mm
T2: Tumor >20 mm pero ≤50 mm
T3: Tumor >50 mm
T4: Tumor de cualquier tamaño que invade directamente la pared torácica y/o la piel (ulceración)
Ganglios
N0: no afectación ganglionar
N1: Ganglios móviles en la axila
N2: Metástasis en ganglios linfáticos axilares fijos, o afectación de los ganglios de la cadena mamaria interna sin afectación de la axila
N3: metástasis en los ganglios supra o infraclaviculares, o afectación de la cadena mamaria interna y afectación axilar
Metástasis
M0: no metástasis
M1: metástasis en otros órganos
Contenido relacionado
- ¿Cómo clasificamos el cáncer de mama que me han diagnosticado?
- Tratamientos personalizados en cáncer de mama
Diagnóstico: ¿Qué pruebas me van a realizar?
- Escrit per: Equip de redacció
- Categoria: General

Es importante clasificar y conocer todos los aspectos del cáncer de mama para que pueda tratarse de forma óptima en todos los pacientes, ya que no todos los cánceres de mama son iguales.
A continuación, se presentan algunas de las pruebas más comunes durante el proceso diagnóstico del cáncer de mama. Es importante tener en cuenta que no todas están indicadas en todos los casos; el equipo médico valorará cuáles son apropiadas según las características de cada paciente.
Historia clínica exhaustiva
Durante la entrevista con el médico, se recopilará información sobre sus antecedentes personales, como enfermedades previas, cirugías, medicación habitual y posibles alergias a medicamentos o contrastes. También se recogerán datos ginecológicos relevantes, como el uso de anticonceptivos o tratamientos hormonales, embarazos, controles ginecológicos y si la paciente está en etapa premenopáusica o posmenopáusica. Además, se explorarán los hábitos de vida, incluyendo alimentación, actividad física, entre otros. Por último, se valorarán los antecedentes oncológicos familiares, ya que algunos tipos de cáncer pueden tener un componente hereditario.
Examen físico
El médico realizará una exploración física general, poniendo especial atención en las mamas y en las zonas cercanas donde pueden encontrarse ganglios linfáticos, como las axilas, la parte superior e inferior de la clavícula y el cuello.
Análisis sanguíneos
Antes de iniciar el tratamiento quirúrgico o médico, se realizará una analítica general para comprobar que el organismo funciona correctamente, incluyendo parámetros como la función del riñón, del hígado y el estado de las defensas. En algunos casos, también puede ser necesario valorar el estado hormonal, especialmente si hay dudas sobre si la paciente ha llegado o no a la menopausia.

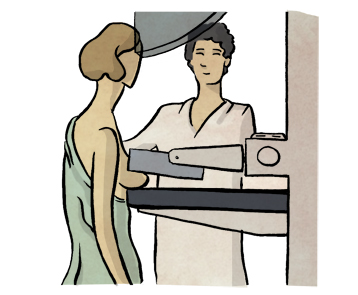
Mamografía bilateral
La mamografía es una prueba de imagen clave en el diagnóstico del cáncer de mama. Se utiliza tanto en programas de cribado poblacional (para detectar tumores en fases tempranas, antes de que den síntomas), como en mujeres con sospecha de enfermedad. En general, se realiza a todas las pacientes, salvo en casos puntuales en los que esté contraindicada.
La técnica emplea rayos X para visualizar el tejido mamario y detectar posibles masas o microcalcificaciones. Es fundamental que se realice de forma bilateral (en ambas mamas), ya que el cáncer puede aparecer en las dos. En mujeres con prótesis mamarias, la sensibilidad de la prueba puede disminuir ligeramente.
En los últimos años, en algunos casos seleccionados, se ha comenzado a usar la mamografía con contraste, que mejora la capacidad para detectar lesiones y puede llegar a tener una eficacia diagnóstica similar a la de la resonancia magnética.
¿Cómo se realiza?
La paciente coloca la mama sobre una plataforma, y otra placa ejerce presión desde arriba para comprimirla durante unos segundos. Aunque puede resultar molesto o incluso algo doloroso, esta presión es necesaria para obtener imágenes de buena calidad. Se recomienda acudir con un sujetador cómodo y no usar desodorante ese día, ya que puede interferir con la imagen.
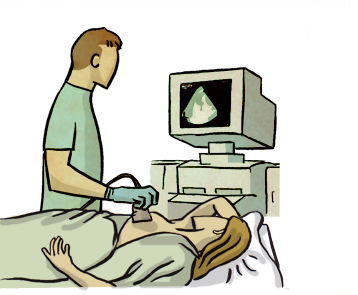
Ecografía
Es una prueba de imagen complementaria a la mamografía. Funciona con ultrasonidos, no con radiación, y permite ver con más detalle algunas zonas del tejido mamario. También es útil para explorar los ganglios linfáticos, sobre todo en la axila. Además, se usa como guía para realizar biopsias o punciones cuando se detecta una lesión sospechosa..
Resonancia magnética mamaria
Es una prueba de imagen también complementaria a la mamografía y ecografía. Es más sensible que la mamografía para valorar algunas lesiones y aporta más información de ambas mamas y algunos territorios linfáticos. Aporta más detalles de las lesiones y, en ocasiones (en función de la densidad del tejido mamario o la presencia de prótesis mamaria), es la prueba de imagen de primera elección. Está contraindicada en caso de que el paciente sea portador de prótesis metálicas o marcapasos ya que utiliza un imán de gran escala para obtener la imagen. Para mejorar la visualización de las lesiones, se administra un contraste por vía intravenosa. Es importante informar al médico si ha tenido alergias a contrastes o si tiene problemas renales.
Gammagrafía ósea
La gammagrafía ósea es una prueba de imagen utilizada para detectar si el cáncer se ha extendido a los huesos. Consiste en la administración de un fármaco ligeramente radiactivo que se fija en las zonas del hueso con mayor actividad, como puede ocurrir en caso de metástasis. Tras la inyección, es necesario esperar un tiempo (unas 2 horas) para que el fármaco se distribuya correctamente por el cuerpo. Luego, el paciente se acuesta en una camilla y una cámara gamma capta la radiación emitida, generando imágenes que muestran posibles alteraciones óseas. Las zonas con mayor captación del fármaco se visualizan como puntos más intensos, lo que ayuda a identificar áreas sospechosas. La prueba es indolora y suele durar entre 20 y 30 minutos.
Tomografía computarizada (TC)
La TC (tomografía computarizada) es una prueba de imagen que utiliza rayos X y un sistema informático para obtener imágenes detalladas del interior del cuerpo. Aunque no es la técnica principal para estudiar la mama en sí, en el contexto del cáncer de mama se utiliza sobre todo para valorar si la enfermedad se ha extendido a otros órganos, como los pulmones, el hígado o los huesos.
Se suele realizar cuando hay sospecha de metástasis o en estadios más avanzados de la enfermedad. En muchos casos, se administra un contraste por vía intravenosa para mejorar la visibilidad de los órganos y posibles lesiones. La prueba es rápida, indolora y suele durar solo unos minutos. Es importante informar al médico si se tiene alergia al contraste o problemas renales.
Tomografía de emisión de positrones (PET)
El PET (tomografía por emisión de positrones) es una prueba de imagen que detecta la actividad de las células en el cuerpo utilizando pequeñas cantidades de sustancias radiactivas. La más común es la glucosa marcada con flúor (FDG), ya que las células usan glucosa como fuente de energía. Como las células cancerosas suelen tener una actividad mayor, el PET permite identificarlas por su mayor captación del marcador. No se realiza de forma rutinaria en todos los pacientes, pero está indicada cuando otras pruebas, como el TAC o la gammagrafía ósea, no son concluyentes y se necesita descartar la presencia de metástasis. Para su realización, es necesario acudir en ayunas (al menos 6 horas antes) y la paciente deberá informar si tiene diabetes, ya que puede alterar los resultados. La prueba en total puede durar entre 1,5 y 2 horas, incluyendo el tiempo de espera tras la administración del fármaco y el escaneo.
Biopsia o citología
El diagnóstico definitivo de cáncer se establece siempre a través del análisis al microscopio de una muestra del tumor, que se estudia en el laboratorio de anatomía patológica. Esta muestra se obtiene mediante una biopsia (más recomendable por ofrecer mayor cantidad de tejido y células) o una citología (menos invasiva, aunque con menor rendimiento diagnóstico). Para extraer las células se pueden utilizar distintos métodos, como la PAAF (punción-aspiración con aguja fina) o la BAG (biopsia con aguja gruesa), que suelen realizarse guiadas por ecografía. Es importante informar al médico si está tomando medicamentos que alteran la coagulación, como Aspirina® o Sintrom®, para prevenir posibles sangrados tras el procedimiento.
Estudio de anatomía patológica
Una vez se obtienen las muestras de tejido, es fundamental realizar un análisis anatomo-patológico exhaustivo al microscopio para establecer el diagnóstico definitivo de cáncer. Se analizan de manera rutinaria una serie de características en las células, en función de las cuales podemos clasificar el cáncer de mama en los distintos subtipos, valorar su agresividad y así seleccionar un tratamiento adecuado para cada paciente. Algunas de las características evaluadas son:
- Tipo histológico: en función de las células en donde se origine el tumor. Los más frecuentes son el tipo ductal o lobulillar.
- Receptores hormonales: principalmente los receptores para dos tipos de hormonas, los estrógenos y la progesterona. En algunos casos se pueden valorar también los receptores de andrógenos. Los tumores que expresan receptores hormonales en sus células se benefician de un tratamiento hormonal.
- HER2: Es indispensable, evaluar la sobreexpresión o no de este receptor en las células tumorales, ya que estos tumores tienen un tratamiento específico con fármacos dirigidos selectivamente a estas células.
- Grado histológico: puede ser bajo, moderado o alto, según el grado de maduración o diferenciación (que tan parecidos son a una célula normal) de las células tumorales. Los tumores de alto grado son más agresivos que los tumores de bajo grado.
- Ki 67: es una proteína que determina el índice de proliferación celular, es decir, el porcentaje de células que se encuentran multiplicándose en un momento determinado. Su valor viene informado como un porcentaje de 1 a 100%. Cuanto más alto es el porcentaje, mayor es la agresividad del tumor.
Perfiles de expresión genética del tumor: Plataformas moleculares
Los perfiles de expresión genética del tumor, también conocidos como plataformas moleculares o génicas, son pruebas que analizan la actividad de determinados genes en las células tumorales para conocer mejor su comportamiento, especialmente su agresividad y el riesgo de recaída. Para realizar estos estudios es necesaria una muestra del tumor, que se obtiene habitualmente durante la biopsia o la cirugía.
En algunos casos de cáncer de mama hormonosensible, estas pruebas ayudan a decidir si es necesario añadir quimioterapia a la terapia hormonal, sobre todo cuando las pruebas convencionales no permiten tomar una decisión clara. El análisis se realiza a partir de una muestra del tumor, obtenida en la biopsia o durante la cirugía.
Estas plataformas no se utilizan en todos los casos; su indicación depende de las características del tumor y del momento del tratamiento. Las más empleadas actualmente son Prosigna®, Oncotype®, Mammaprint® y Endopredict®, todas validadas científicamente.
Además, en tumores HER2 positivos, algunos centros han comenzado a usar HER2DX®, una herramienta desarrollada en el Hospital Clínic de Barcelona por el Dr. Aleix Prat, que permite afinar aún más las decisiones terapéuticas según el perfil molecular del tumor.
Biopsia líquida
Cuando se diagnostica un cáncer, es esencial conocer su tipo y características moleculares. Tradicionalmente, esto se logra mediante una biopsia de tejido, que permite analizar el tumor al microscopio y determinar su comportamiento y pronóstico. Sin embargo, en los últimos años ha emergido una herramienta complementaria: la biopsia líquida.
La biopsia líquida consiste en analizar fragmentos de ADN tumoral circulante (ctDNA) presentes en la sangre. Este ADN proviene de células tumorales que liberan material genético al torrente sanguíneo. Mediante técnicas avanzadas, es posible detectar mutaciones específicas del tumor, lo que permitiría:
- Monitorear la evolución del cáncer y su respuesta al tratamiento.
- Detectar recaídas antes de que sean evidentes en estudios de imagen.
- Identificar mutaciones que puedan guiar terapias dirigidas.
Un ejemplo destacado es la implementación por parte del NHS en Inglaterra de pruebas de biopsia líquida para detectar la mutación ESR1 en pacientes con cáncer de mama metastásico. Esta mutación, asociada a resistencia a tratamientos hormonales, puede ser tratada con el fármaco elacestrant, mejorando la supervivencia de las pacientes .
Además, estudios recientes han demostrado que la detección de ctDNA puede predecir la recaída del cáncer de mama antes de que sea detectable por métodos convencionales, lo que abre la puerta a intervenciones más tempranas y personalizadas .
Sin embargo, la biopsia líquida no está exenta de desafíos. No todos los tumores liberan suficiente ctDNA para ser detectado, y las mutaciones pueden variar entre pacientes. Además, es posible detectar alteraciones genéticas que nunca llegarían a causar enfermedad, lo que plantea el riesgo de sobretratamiento.
A pesar de su gran potencial, la biopsia líquida aún no se ha generalizado en la práctica clínica debido a varios factores. Entre ellos se encuentran la falta de estandarización de las técnicas disponibles, la variabilidad en la sensibilidad y especificidad —especialmente en fases tempranas del cáncer—, su elevado coste y el hecho de que todavía no existe suficiente evidencia clínica para avalar su uso rutinario. Además, presenta limitaciones técnicas que requieren equipamiento avanzado y personal especializado, lo que restringe su implementación en muchos centros sanitarios.
A pesar de estas limitaciones, la biopsia líquida representa un avance significativo hacia una medicina de precisión, permitiendo tratamientos más personalizados y menos invasivos. Su uso continúa expandiéndose, y se espera que en los próximos años se convierta en una herramienta estándar en el manejo del cáncer de mama y otros tipos de cáncer.
Contenido relacionado
{KomentoLock}
¿Qué es el cáncer de mama?
- Escrit per: Equip de redacció
- Categoria: General
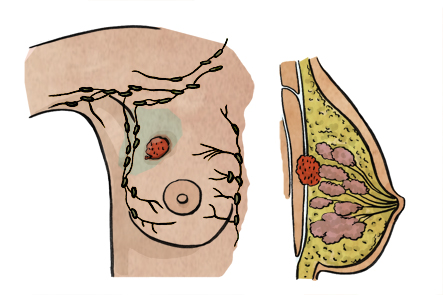
Desde que nacemos el organismo está en continuo cambio, produciéndose un crecimiento y renovación de las múltiples células que constituyen nuestro cuerpo. Este proceso está altamente regulado para evitar que se produzcan errores. Sin embargo, en algunas ocasiones se producen alteraciones en estos procesos, que acabarán produciendo una reproducción celular incontrolada, ajenas a los mecanismos de control.
El cáncer de mama es una proliferación incontrolada de las células que constituyen el tejido de la glándula mamaria, pudiendo afectar tanto a mujeres (99% de los casos) como a hombres.
Es la neoplasia más diagnosticada entre las mujeres españolas, con 34.750 casos en 2022 según cifras de GLOBOCAN. Aunque en los últimos años han aumentado los casos, gracias al avance en las técnicas diagnósticas y a las mejoras en los programas de cribado o prevención, la gran mayoría de los nuevos casos se diagnostican en una situación temprana y por lo tanto en un escenario potencialmente curativo.
La mayoría de los cánceres de mama son carcinomas y aunque inicialmente se clasificaron en diferentes subtipos según su probable origen dentro de la propia glándula mamaria, en la actualidad se habla de carcinoma infiltrante y se mantienen los diferentes "nombres" para su clasificacion:
- Ductal: en la superficie del conducto mamario. Es el tipo más frecuente.
- Lobulillar: en el lobulillo de una glándula mamaria.
- Otros: mucinoso, tubular, medular, papilar, metaplásico, apocrino, tumor filoides maligno, enfermedad de Paget de la mama.
El carcinoma se considera in situ, intraductal o no invasivo, cuando las células malignas no han invadido el tejido normal que rodea la lesión, es decir las células se mantienen dentro del conducto sin romperlo.
El carcinoma es invasivo, cuando las células se han propagado a través de las paredes del conducto, afectando al tejido mamario cercano. Las células de los carcinomas invasivos tienen la capacidad de afectar otros órganos distintos a la mama a través de los conductos linfáticos y la sangre.
Cuando el cáncer de mama se disemina hacia los ganglios linfáticos, generalmente lo hace a los ganglios más próximos, estos son los que se encuentran en la axila. En otras ocasiones, las células pueden migrar a los ganglios que se encuentran debajo de las costillas (mamaria interna) o alrededor de la clavícula (infra y supraclavicular).
En algunos pacientes, el tumor puede diseminarse a través de la sangre hacia otros órganos del cuerpo, es lo que se conoce como metástasis. Los órganos más frecuentemente afectados son los huesos, los pulmones y el hígado. Aunque la mayoría de las pacientes se diagnostican en estadios tempranos, aproximadamente un 5% de las pacientes tendrán metástasis en otros órganos en el debut de la enfermedad.
Participa
- Escrit per: Equip de redacció
- Categoria: General

Xemio es una plataforma digital gratuita, que se sostiene mediante becas, micromecenazgo y la colaboración voluntaria de personas. Necesitamos la máxima colaboración para conseguir mantener XEMIO, un proyecto que ayuda a los enfermos de cáncer de mama a vivir mejor el día a día de la enfermedad cuando estén en su casa durante el tratamiento.
Haz una donación
* Cómo donar y cantidad a donar
La que quieras, tantas veces como quieras. Para recibir justificante de la Fundación, así como el certificado fiscal necesitamos disponer de tus datos completos. Para la emisión del certificado envianos un email con tu nombre completo/razón social, dirección y NIF/CIF a
Pago mediante transferencia bancaria
IBAN: ES09 2100 0555 3002 0244 3078
Ordenante: No olvides especificar tu nombre y apellido
Beneficiario: Fundación iSYS
Pago mediante transferencia
Pago mediante Teaming
Si quieres, puedes colaborar con 1€/mes
¡Muchas gracias!
* Beneficios fiscales
Las donaciones a fundaciones acogidas a la Ley 49/2002 tienen importantes deducciones fiscales:
- Para personas físicas (IRPF):
- 80% de deducción en los primeros 250€ donados.
- 40% (o 45% si la donación se mantiene durante al menos 3 años) en el resto.
- Límite del 15% de la base liquidable del IRPF.
- Para empresas (Impuesto sobre Sociedades):
- 40% de deducción sobre la cantidad donada (o 50% si se mantiene durante 3 años seguidos).
- Límite del 15% de la base imponible.
Colaboradores
- Escrit per: Equip de redacció
- Categoria: General
Xemio es posible gracias a las aportaciones que la Fundación iSYS ha conseguido gracias a donativos y patrocinios, becas y la colaboración voluntaria de profesionales de salud y organizadores y participantes de eventos solidarios.
La versión actual de la App, con la que la Fundación iSYS participa en el proyecto europeo H2020 ASCAPE ha contado con el apoyo de:
Versiones anteriores de la App, contaron con el apoyo de iniciativas solidarias como los festivales del Music for cancer Tribute (M4C Tribute) celebrados en la Antigua Fábrica de cerveza Damm y la Capilla de Santa Àgata, y los actos organizados por la Americana, Custo Barcelona, RideForHer y otros.
¡Gracias por vuestra ayuda!

M. Corral
C. Duran
J. Grau
S. Grau
D. López
B. Mulholland
M.Muñoz
M. Robert
A-L

P. Aparicio
M. Ara
J. Ara
P. Arilla
L. Aznar
N. Balcells
RM Bautista
C. Boronat
C. Bonilla
F. Calvo
R. Català
M. Català
M. Català
M. Català
C. Carmona
V. Cole
S. Colmenedo
F. Cosentino
L. Del Castillo
M. Díaz
M. Domenech
C. Domingo
J.M. Egea
B. Ejarque
M.A. Elorza
J.L. García
A. García
P. Gascon
A. Genebat
M. Genebat
C. Grau
R. Grau
X. Grau
F. Herrero
X. Jiménez
H. Lacalle
L-Z

M. Lacalle
P. Lacalle
E. López
J. Maristany
P. Maristany
JL Martínez
Menja.bé
I. Nafría
A. Nohales
M. Pi
E. Puig
M. Puig
S. Pujalte
A. Rodriguez
P. Rodriguez
E. Rojas
A. Roig
S. Soler
N. Sánchez
A. Sanz
M. Tarradellas
S. Torre
S. Torrents
P. Vendrell
E. Vendrell
M. Vicente
M.A. Villanueva
Con el apoyo de:









